フラグメント解析 よくある質問(FAQ)
全て表示する
全て閉じる
- ▼Q、STR解析(マイクロサテライト解析)を行う場合、推奨のPCR酵素はありますか?
-
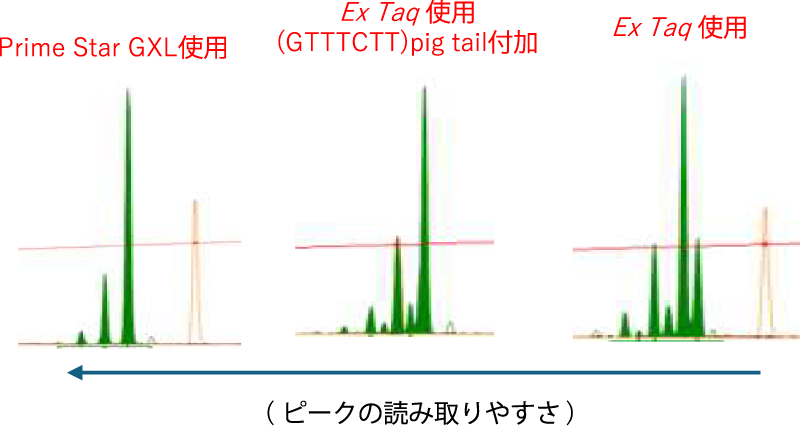
A. STR解析はリピート配列を含みますので、3’→5’エキソヌクレアーゼ活性の強い酵素(Prime Star GXL等)の方がスタッターピーク(リピート配列による生じる複数のピーク)を抑えられる為おすすめです。Taq 系の酵素を使用する場合は、リピート配列による酵素のスリッページによる複数のピークが生じ、また酵素の特性上生じる3’末端のA付加の現象も重なって、ピークサイズの読み取りが難しくなる傾向にあります。R側プライマーの5’末端に[GTTTCTT]の7塩基を付加させることで、A付加が促進され、少しサイズが読み取りやすくなります。
- ▼Q、EmeraldAmp等の、色素マーカーを加えたPremix酵素でPCRを行っても大丈夫ですか?
-
A. 色素マーカーのDyeがフラグメントの波形に影響を与える可能性があります。色素マーカーが入っていない一般的なPCR酵素にてPCRすることをお勧めいたします。
- ▼Q、サンプルを送付する際は、常温か冷蔵どちらが良いですか?
-
A. 常温でPCR産物を保管していた場合でも、短期間であればサンプルの波形にはほとんど影響を与えないと考えられます。サンプルの着日が翌日であれば、常温便でお送りいただいて問題ございません。
- ▼Q、50bp以下の位置に見られる強度の強い塊のようなピークは何ですか?
-
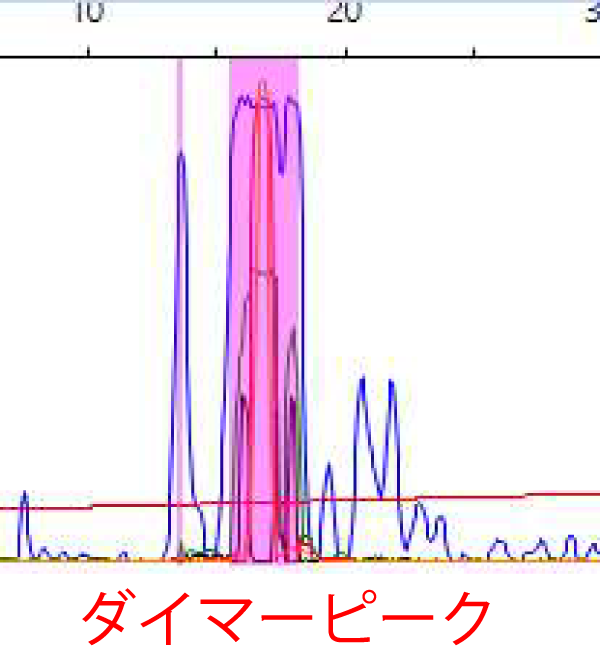
A. 50bp以下のサイズにみられる場合は、プライマーのダイマーピークであると考えられます。ダイマーピークが強すぎる場合は、サイジングがうまく出来ない可能性があります。その場合の対処法としては、下記をご参照ください。
- ▼Q、目的サイズと異なる幅の広いピークが所々に見られるのですが、これは何ですか?
-
A. 通常のシャープなピークとは異なる幅の広いピークは、蛍光Dyeが分解して生じたピークだと思われます。これらのピークは、古く劣化した蛍光プライマーを使用した場合などに生じる可能性があり、目的の位置とは関係なく出現します。サイズスタンダードのピークやその他のピークよりピーク幅が広くなっていて特徴的です。

- ▼Q、選択するサイズスタンダードによって検出されるフラグメントサイズは変わりますか?
-
A. 泳動に使用するサイズスタンダードの種類によって、フラグメントサイズに若干違いが生じます。データ間での互換性を持たせる為には、同じサイズスタンダードを継続して使用することをお勧めします。
- ▼Q、泳動する際のシーケンサーの機種・ポリマー・キャピラリー長の違いで検出されるフラグメントサイズは変わりますか?
-
A. 上記の条件が異なる場合、フラグメントサイズに若干違いが生じます。弊社機器の泳動条件は、シーケンサー:DNA analyzer 3730xl、ポリマー:POP7、キャピラリー長:50cmキャピラリーとなります。データ間での互換性を持たせる為には、同条件(シーケンサー機種、ポリマー、キャピラリー長)による泳動を行うことをお勧めします。
- ▼Q、G5のFilter setにおいて、VICやNED等のFilter対応の色素ではなく、HEXやTET等の異なる色素を使用しても大丈夫ですか?
-
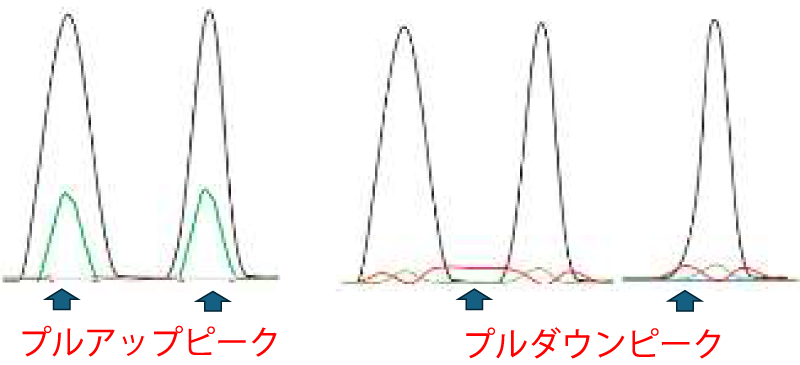
A. G5 Filter setに限らず、Filter set対応以外の色素での泳動は可能です。しかし本来の色素とは少し波長が異なり、ピークの漏れ込みをソフトが補正する為、プルアップピークやプルダウンピークといった現象が生じます。ピークのサイズ値には影響を与えないと考えられますが、対応色素以外の泳動結果につきましては、弊社で保証いたしかねますことをご了承ください。
- ▼Q、蛍光の種類や長さが異なるサンプルを、一つのウェルにプールして泳動することは可能ですか?
-
A. 可能です。あらかじめユーザー様の方でサンプルをプールして頂く必要がございます。価格につきましては、ウェル数分のみの料金となります。またその場合の電気泳動写真につきましては、プール前の個別のサンプルについて電気泳動するのではなく、一つのウェルにプールした後のサンプルを電気泳動していただきますようお願いします。
- ▼Q、フラグメント解析のピーク高や面積比によって定量は可能ですか?
-
A. 同一プライマー、同一ウェル内で増幅されたアリル同士のようなピーク間であれば、相対的な定量は可能です。一般的に、得られたピークの高さや面積比は、もとのテンプレートの存在量を反映していると考えられます。
- ▼Q、解析によって得られたサイズ値(bp)は絶対サイズ値(塩基数)ですか?
-
A. 絶対サイズ値(塩基数)ではなく、サイズスタンダードの検量線から得られた相対的なサイズです。そのため、フラグメント解析で得られたサイズの値が、シーケンス解析で得られた塩基数と完全に一致する可能性は低く、少々誤差が生じると考えられます。絶対サイズ値(塩基数)を調べる必要がある場合は、シーケンス解析の実施をお願いいたします。
- ▼Q、PowerPlex、GlobalFiler、MLPA kitなどで増幅したプロダクトも泳動可能ですか?
-
A. 泳動可能です。上記のようなPCR kitを使用された場合、プロダクト濃度が薄くアガロースゲルの電気泳動ではバンドを検出できないと考えられますので、電気泳動写真の同封は不要です。
- ▼Q、 SNaPshotによるSNPのタイピングは可能ですか?
-
A. 可能ですが、条件がございます。弊社のシーケンサー(POP7ポリマーならびに50cmキャピラリー)にて泳動した場合、20bpのピークが30bp前後までシフトする現象が生じます(社内にてデータ検証済みです)。シングルマーカーにて泳動する場合は、サイズが多少ずれても判定可能かと思いますが、マルチププール(複数マーカー)で同時泳動する場合、20bpのマーカーは想定とは異なる位置にピークが出現する為、Dyeの識別が困難になる可能性がございます。

